本試劑盒僅供科研使用。用于體外定量檢測兔血清、血漿或細胞培養(yǎng)上清液中的TNF-α濃度。使用前請仔細閱讀說明書并檢查試劑組分是否完整。如有產品包裝破損或質量投拆,請在收到貨一個月之內聯(lián)系我們。
TNF-α簡介:
腫瘤壞死因子(TNF-α)是由單核細胞和巨噬細胞產生的多肽類細胞因子,在炎癥反應、免疫系統(tǒng)的發(fā)展、細胞程序性死亡和脂代謝中起重要的作用。兔TNF-α由35個氨基酸的胞內部,21個氨基酸的穿膜部分,179個氨基酸的胞外部分組成,從ECD部分來說,兔TNF-α與牛,貓,馬,小鼠,豬,大鼠和恒河猴等TNF-α有76%~83%的氨基酸同源性。
TNF-α功能主要是在免疫反應中是一個多功能的調節(jié)器甚至作為一個強烈的熱原性物質刺激中性粒細胞,改變血管內皮細胞的特性,調節(jié)其它組織的代謝活性。TNF-α也可通過抑制脂蛋白脂肪酶的活性而導致惡液病。愛潑斯坦病毒引起的B細胞活化也可被TNF-α所抑制。巨噬細胞表面的淋巴因子和肉毒素也可介導包括上皮細胞、內皮細胞和腫瘤細胞等產生TNF-α。據(jù)報道干擾素能顯著提高TNF-α的分泌量。
TNF-α在關節(jié)炎和其它組織的炎癥的發(fā)病機理中起重要作用。TNF-α也參與了包括哮喘、克羅恩氏病、類風濕性關節(jié)炎、神經性疼痛、肥胖癥、型糖尿病、自身免疫病和腫瘤等疾病的發(fā)生
檢測原理:
本試劑盒采用雙抗體夾心ELISA法檢測樣本中兔TNF-α的濃度。兔TNF-α捕獲抗體已預包被于酶標板上,當加入標本或參考品時,其中的兔TNF-α會與捕獲抗體結合,其它游離的成分通過洗滌的過程被除去。當加入生物素化的抗兔TNF-α抗體后,抗兔TNF-α抗體與兔TNF-α接合,形成夾心的免疫復合物,其它游離的成分通過洗滌的過程被除去。隨后加入辣根過氧化物酶標記的親合素。生物素與親合素特異性結合,親合素連接的酶就會與夾心的免疫復合物連接起來;其它游離的成分通過洗滌的過程被除去。最后加入顯色劑,若樣本中存在TNF-α將會形成免疫復合物,辣根過氧化物酶會催化無色的顯色劑氧化成藍色物質,在加入終止液后呈黃色。通過酶標儀檢測,讀其450nm處的OD值,兔TNF-α濃度與OD450值之間呈正比,通過參考品繪制標準曲線,對照未知樣本中OD值,即可算出標本中TNF-α濃度。
兔TNF-α定量分析酶聯(lián)免疫檢測試劑盒組成:
組分 | 規(guī)格(96T/48T) |
兔TNF-α預包被板 | 12條/6條 |
樣本分析緩沖液 | 5ml |
標準品稀釋液 | 10ml/5ml |
兔TNF-α標準品 | 2支/1支(凍干) |
兔TNF-α生物素化抗體 | 10ml/5ml |
親和素連接的HRP酶 | 10ml/5ml |
濃縮洗滌液 20× | 30ml/15ml |
TMB底物 | 10ml/5ml |
終止液 | 5ml/3ml |
封板膠紙 | 3/2張 |
說明書 | 1份 |
標本收集:
1.標本的收集請按下列流程進行操作;
A.細胞上清標本離心去除懸浮物后即可;
B.血清標本應是自然凝固后,取上清,避免在冰箱中凝固血液;
C.血漿標本,推薦用EDTA的方法收集
D.若待測樣本不能及時檢測,標本收集后請分裝,凍存于-20℃,避免反復凍融。
2.血清標本不應添加任何防腐劑或抗凝劑;
3.標本應清澈透明,檢測前樣本中如有懸浮物應通過離心去除。
4.請勿使用溶血,高血脂或污染的標本檢測,否則結果將不準確。
注:兔血清或血漿樣本請用樣本分析緩沖液做倍比稀釋后再檢測。
注意事項:
1.試劑盒請保存在2~8℃。
2.濃縮洗滌液因在低溫下可能有結晶,請水浴加熱使結晶完全溶解后再配制工作液。
3.標準品復溶加樣后,剩余部份請丟棄。
4.底物請勿接觸氧化劑和金屬。
5.加樣時,請及時更換槍頭,避免交叉污染。
6.嚴禁混用不同批號的試劑盒組份。
7.充分混勻對保證反應結果的準確性很重要,在加液后請輕輕叩擊邊緣以保證混勻。
8.室溫反應,請嚴格控制在25~28℃。
9.洗滌過程是至關重要的,洗滌不充分會使精確度下降并導致結果誤差較大。
10.試驗中標準品和樣本檢測時建議作雙復孔。
11.加樣過程中避免氣泡的產生。
12.血清和血漿標本的檢測時,檢測抗體的孵育時間應適當延長。
檢測前準備工作:
1. 試劑盒自冰箱中取出后應置室溫(25-28℃)平衡20分鐘;每次檢測后剩余試劑請及時于2~8℃保存。
2. 將濃縮洗滌液用雙蒸水或去離子水稀釋(1份加19份水)。
3. 如有5×標準品稀釋液用雙蒸水或去離子水稀釋(1份加4份水)。
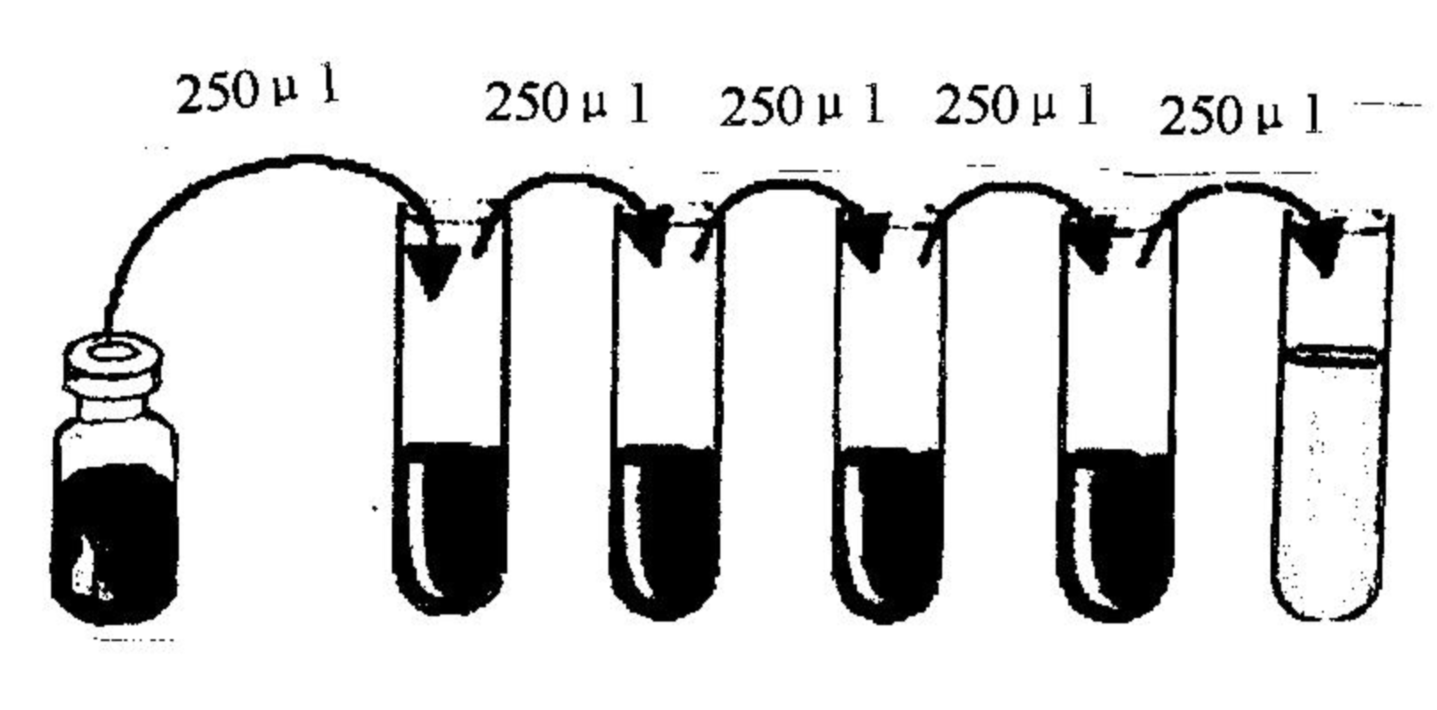
4. 標準品:按標簽復溶體積用1X標準品稀釋液復溶使TNF-α終濃度達到2000pg/ml,室溫反應,請嚴格控制在25~28℃,靜置15~20分鐘后輕輕混勻(建議抽吸幾次)待徹底溶解,用標準品稀釋液倍比梯度稀釋后依次加入檢測孔中。(標準曲線取七個點,最高濃度為2000pg/ml,標準品稀釋液直接加入作為0濃度.)
5. 
洗滌方法:
自動洗板機或人工洗板:每孔洗滌液為300ul,注入與吸出間隔15-30秒。最后一次洗板完成后將板倒扣著在厚吸水紙上用力拍干。
實驗過程需自備的材料:
1不同規(guī)格的加樣槍及相應的槍頭;
2.酶標儀;
3.自動洗板機;
4.去離子水或雙蒸水;
操作步驟:
1.通過計算并確定一次性實驗所需的板條數(shù),取出所需板條放置在框架內,暫時用不到板條請放回鋁箔袋密封,保存于4℃。
2.建議設置本底較正孔,即空白孔,設置方法為該孔只加TMB顯色液和中止液。每次實驗均需做標準品對照并畫出標準曲線。
3.分別將樣品或不同濃度標準品按照100μl/孔加入相應孔中,用封板膜封住反應孔,室溫(25-28℃)孵育120分鐘。對于血清血漿樣本,先加50ul的樣本分析緩沖液,再加50uL樣本。如檢測超出范圍,請先加50ul的樣本分析緩沖液,再加用標準品稀釋液稀釋后的樣本50μl檢測。請注意記錄好樣品的稀釋倍數(shù),此處加樣量50ul相當于已稀釋了2倍。
4.洗板5次,且最后一次置厚吸水紙上拍干。
5.加入生物素化抗體工作液(100ul/孔)。用封板膠紙封住反應孔,室溫(25-28℃)孵育60分鐘。
6.洗板5次,且最后一次置厚吸水紙上拍干。
7.加入親和素連接的HRP酶工作液(100ul/孔)。用封板膠紙封住反應孔,避光室溫(25-28℃)孵育20分鐘。
8.洗板5次,且最后一次置厚吸水紙上拍干。
9.加入顯色劑TMB100ul/孔,避光室溫(25-28℃)孵育20分鐘。
10.加入終止液50ul/孔,混勻后即刻測量OD450值。
結果判斷:
1.復孔的值在20%的差異范圍內結果才有效,復孔的值平均后可作為測量值。
2.每個標準品或標本的OD值應減去本底校正孔的OD值。
3.手工繪制標準曲線。以標準品濃度作橫坐標,OD值作縱坐標,以平滑線連接各標準品的坐標點。通過標本的OD值可在標準曲線上查出其濃度。
4.若標本OD值高于標準曲線上限,應適當稀釋后重測,計算濃度時應乘以稀釋倍數(shù)。
典型數(shù)值和參考曲線
濃度pg/ml | 典型OD值1 | 典型OD值2 | OD平均值 |
0 | 0.117 | 0.099 | 0.108 |
62.5 | 0.253 | 0.247 | 0.25 |
125 | 0.455 | 0.427 | 0.441 |
250 | 0.748 | 0.687 | 0.7175 |
500 | 1.189 | 1.074 | 1.1315 |
1000 | 1.755 | 1.696 | 1.7255 |
2000 | 2.413 | 2.4 | 2.4065 |
兔TNF-α參考標準曲線(向市場部索要)
靈敏度,特異性和重復性:
1.靈敏度:多次重復結果表明,最小檢出量為28.4pg/ml。
2.特異性:與人TNF-α、大鼠TNF-α、小鼠TNF-α、豬TNF-α等沒有交叉反應。
3.重復性:板內,板間變異系數(shù)均<10%.
參考文獻:
1. Schall, T.J. et al. (1990) Cell 61:361.
2. Ito, H. et al. (1986) DNA 5:157.
3. Perez, C. et al. (1990) Cell 63:251.
4. Dembic, Z. et al. (1990) Cytokine 2:231.
5. Moss, M.L. et al. (1997) Nature 385:733.
6. Loetscher, H. et al. (1991) J. Biol. Chem. 266:18324






