本試劑盒僅供科研使用。用于體外定量檢測豬血清、血漿或細胞培養上清液中的IL-2濃度。使用前請仔細閱讀說明書并檢查試劑組分是否完整。如有產品包裝破損或質量投訴,請在收到貨一個月之內聯系我們。
豬IL-2簡介:
IL-2是一種主要由T淋巴細胞產生的多效性的細胞因子,成熟的豬IL-2是134個氨基酸的蛋白,且與人IL-2有72%的同源性。
IL-2 在抗體刺激引起的不同反應階段的T細胞,自然殺傷細胞和B細胞的細胞增殖方面起重要的作用,此外,IL-2還可調節γ干擾素、主要組織相容性抗原的表達,刺激活化的B細胞的增殖和分化,提高自然殺傷細胞的活性和抑制粒細胞/巨噬細胞的的增殖。IL-2還可誘導少膠突細胞的增殖和分化。
檢測原理:
本試劑盒采用雙抗體夾心ELISA法檢測樣本中IL-2的濃度。IL-2捕獲抗體已預包被于酶標板上,當加入標本或參考品時,其中的IL-2會與捕獲抗體結合,其它游離的成分通過洗滌的過程被除去。當加入生物素化的抗豬IL-2抗體后,抗豬IL-2抗體與IL-2接合,形成夾心的免疫復合物,其它游離的成分通過洗滌的過程被除去。隨后加入辣根過氧化物酶標記的親合素。生物素與親合素特異性結合,親合素連接的酶就會與夾心的免疫復合物連接起來;其它游離的成分通過洗滌的過程被除去。最后加入顯色劑,若樣本中存在IL-2將會形成免疫復合物,辣根過氧化物酶會催化無色的顯色劑氧化成藍色物質,在加入終止液后呈黃色。通過酶標儀檢測,讀其450nm處的OD值,IL-2濃度與OD450值之間呈正比,通過參考品繪制標準曲線,對照未知樣本中OD值,即可算出標本中IL-2濃度。
豬IL-2定量分析酶聯免疫檢測試劑盒組成:
組分 | 規格(96T/48T) |
豬IL-2預包被板 | 12條/6條 |
樣本分析緩沖液 | 5ml/3ml |
標準品稀釋液 | 10ml/5ml |
豬IL-2標準品 | 4支/2支(凍干) |
豬IL-2生物素化抗體 | 10ml/5ml |
親和素連接的HRP酶 | 10ml/5ml |
濃縮洗滌液 20× | 30ml/15ml |
TMB底物 | 10ml/5ml |
終止液 | 5ml/3ml |
封板膠紙 | 3/2張 |
說明書 | 1份 |
標本收集:
1.標本的收集請按下列流程進行操作;
A.細胞上清標本離心去除懸浮物后即可;
B.血清標本應是自然凝固后,取上清,避免在冰箱中凝固血液;
C.血漿標本,推薦用EDTA的方法收集;
D.若待測樣本不能及時檢測,標本收集后請分裝,凍存于-20℃,避免反復凍融。
2.血清標本不應添加任何防腐劑或抗凝劑;
3.標本應清澈透明,檢測前樣本中如有懸浮物應通過離心去除。
4.請勿使用溶血,高血脂或污染的標本檢測,否則結果將不準確。
注:豬血清或血漿樣本請用樣本分析緩沖液做倍比稀釋后再檢測。
注意事項:
1.試劑盒請保存在2~8℃。
2.濃縮洗滌液因在低溫下可能有結晶,請水浴加熱使結晶完全溶解后再配制工作液。
3.標準品復溶加樣后,剩余部份請丟棄。
4.底物請勿接觸氧化劑和金屬。
5.加樣時,請及時更換槍頭,避免交叉污染。
6.嚴禁混用不同批號的試劑盒組份。
7.充分混勻對保證反應結果的準確性很重要,在加液后請輕輕叩擊邊緣以保證混勻。
8.室溫反應,請嚴格控制在25-28℃。
9.洗滌過程是至關重要的,洗滌不充分會使精確度下降并導致結果誤差較大。
10.試驗中標準品和樣本檢測時建議作雙復孔。
11.加樣過程中避免氣泡的產生。
12.血清和血漿標本的檢測時,檢測抗體的孵育時間應適當延長
檢測前準備工作:
1.試劑盒自冰箱中取出后應置室溫(25-28℃)平衡20分鐘;每次檢測后剩余試劑請及時于2~8℃保存。
2.將濃縮洗滌液用雙蒸水或去離子水稀釋(1份加19份水)。
3. 如有5×標準品稀釋液用雙蒸水或去離子水稀釋(1份加4份水)。
4.標準品: 按標簽復溶體積加入1X標準品稀釋液使IL-2終濃度達到3000pg/ml,室溫反應,請嚴格控制在25~28℃,靜置15~20分鐘后輕輕混勻(建議抽吸幾次)待徹底溶解,用標準品稀釋液倍比梯度稀釋后依次加入檢測孔中。(標準曲線取七個點,最高濃度為3000 pg/ml,標準品稀釋液直接加入作為0濃度.)
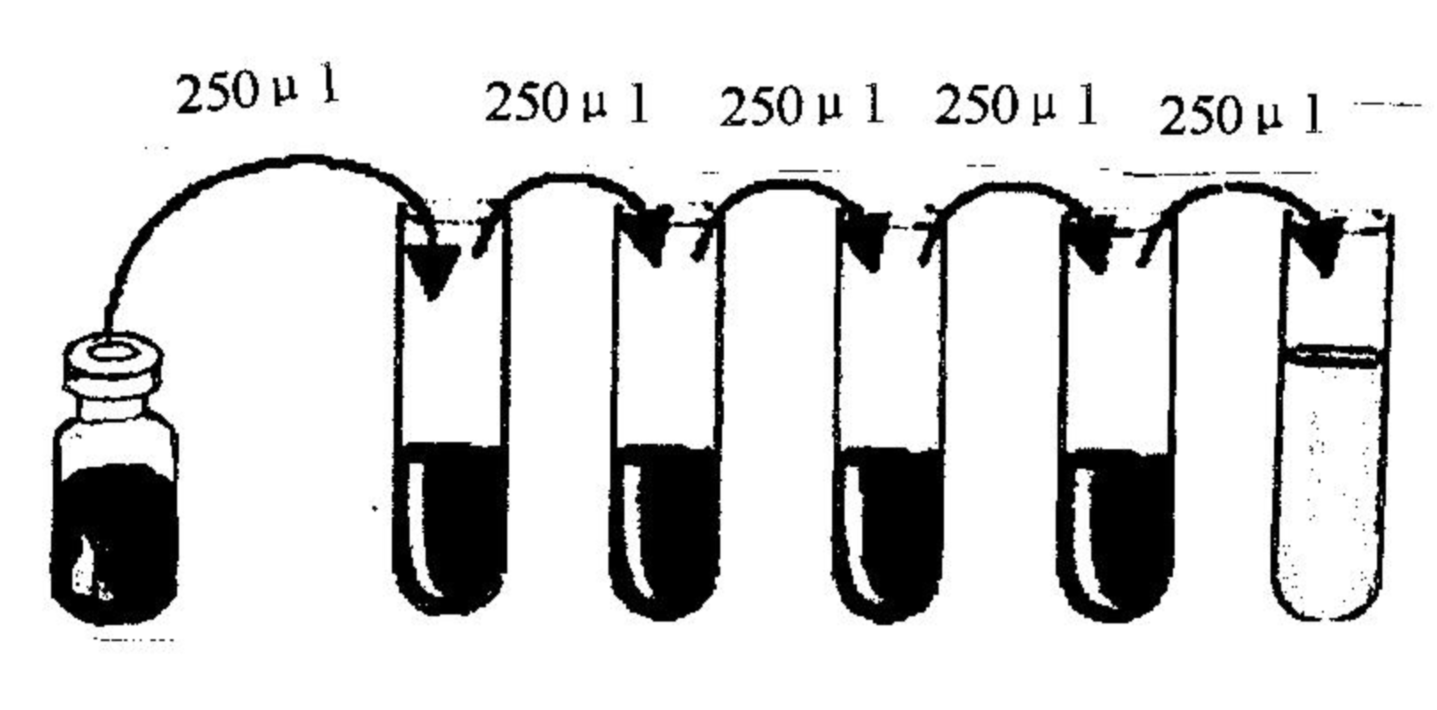
洗滌方法:
自動洗板機或人工洗板:每孔洗滌液為300ul,注入與吸出間隔15-30秒。最后一次洗板完成后將板倒扣著在厚吸水紙上用力拍干。
實驗過程需自備的材料:
1.不同規格的加樣槍及相應的槍頭;
2.酶標儀;
3.自動洗板機;
4.去離子水或雙蒸水;
操作步驟:
1.通過計算并確定一次性實驗所需的板條數,取出所需板條放置在框架內,暫時用不到板條請放回鋁箔袋密封,保存于4℃。
2.建議設置本底較正孔,即空白孔,設置方法為該孔只加TMB顯色液和中止液。每次實驗均需做標準品對照并畫出標準曲線。
3. 分別將樣品或不同濃度標準品按照100μl/孔加入相應孔中,用封板膜封住反應孔,室溫(25-28℃)孵育120分鐘。對于血清血漿樣本,先加50ul的樣本分析緩沖液,再加50uL樣本。如檢測超出范圍,請先加50ul的樣本分析緩沖液,再加用標準品稀釋液稀釋后的樣本50μl檢測。請注意記錄好樣品的稀釋倍數,此處加樣量50ul相當于已稀釋了2倍。
4.洗板5次,且最后一次置厚吸水紙上拍干。
5.加入生物素化抗體工作液(100ul/孔)。用封板膠紙封住反應孔,室溫(25-28℃)孵育60分鐘。
6.洗板5次,且最后一次置厚吸水紙上拍干。
7.加入親和素連接的HRP酶(100ul/孔)。用封板膠紙封住反應孔,避光室溫(25-28℃)孵育20分鐘。
8.洗板5次,且最后一次置厚吸水紙上拍干。
9.加入顯色劑TMB100ul/孔,避光室溫(25-28℃)孵育20分鐘。
10.加入終止液50ul/孔,混勻后即刻測量OD450值。
結果判斷:
1.復孔的值在20%的差異范圍內結果才有效,復孔的值平均后可作為測量值。
2.每個標準品或標本的OD值應減去本底校正孔的OD值。
3.手工繪制標準曲線。以標準品濃度作橫坐標,OD值作縱坐標,以平滑線連接各標準品的坐標點。通過標本的OD值可在標準曲線上查出其濃度。
4.若標本OD值高于標準曲線上限,應適當稀釋后重測,計算濃度時應乘以稀釋倍數。
典型數值和參考曲線
濃度pg/ml | 典型OD值1 | 典型OD值2 | OD平均值 |
0 | 0.092 | 0.123 | 0.1075 |
93.75 | 0.231 | 0.307 | 0.269 |
187.5 | 0.364 | 0.479 | 0.4215 |
375 | 0.647 | 0.778 | 0.7125 |
750 | 0.958 | 1.086 | 1.022 |
1500 | 1.427 | 1.746 | 1.5865 |
3000 | 1.977 | 2.525 | 2.251 |






